听力丧失是最常见的感觉障碍。 虽然基因治疗已成为听力丧失等遗传性疾病的有希望的治疗方法,但它依赖于基因传递载体的鉴定。 腺相关病毒(AAV)载体介导的基因治疗已经在美国被批准用于治疗罕见的遗传性眼病,但尚未鉴定出能够靶向多种类型的内耳细胞的安全且有效的载体。2019年8月19号,上海科技大学钟桂生研究团队等人在Nature Communications上在线发表了题为AAV-ie enables safe and efficient gene transfer to inner ear cells的研究论文。该研究鉴定出一种新型AAV变体,AAV-ie,可用于小鼠内耳中的基因递送。AAV-ie能高效转导耳蜗支持细胞(SCs),代表了对传统AAV血清型的巨大改进。 此外,在AAV-ie介导的Atoh1基因转移后,研究人员发现许多SC转分化为新的HC。 该研究结果表明,AAV-ie是一种有用的工具,可用于耳蜗基因治疗和研究HC再生的机制。

听力丧失是最常见的感官障碍之一,影响着世界6.8%的人口(约5亿人)。最新的听力损失疗法是使用听力装置,它可以放大声音,增强声音传播,或直接刺激神经元。这种方法目前是治疗听力损失的最佳选择,但不幸的是,在嘈杂的环境中,听觉灵敏度和自然声音的感知仍有局限性。因此,治疗听力损失需要更好的替代策略,并且开发用于恢复听觉功能的生物治疗有强烈的临床需求。最近,基因治疗已成为治疗遗传性疾病的可能和有希望的策略。美国食品和药物管理局(FDA)于2017年批准了首例针对罕见遗传性眼病患者的腺相关病毒(AAV)介导的基因治疗,该研究揭示了潜在的基因疗法治疗听力损失。
耳蜗中的毛细胞(HC)和支持细胞(SC)都可以作为基因治疗的目标。 有两种类型的感觉HC:外部HC(OHCs),其放大声音,和内部HC(IHC),其将声波转换为电信号。 SC位于内部和外部HC之间,并将感觉上皮锚定到基底层,保护HC并保持其环境。 感觉神经性听力损失的一半是由于HCs和SCs8的基因突变引起的。 一些关键耳聋基因主要在SCs9中表达并具有功能,如GJB2,它影响SCs的间隙连接,是最常见的遗传性耳聋基因。
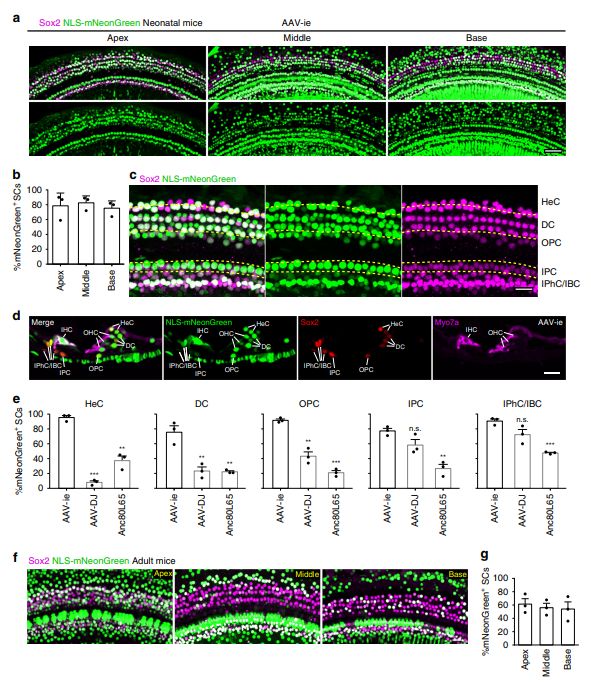
在哺乳动物中,非遗传性感觉神经性听力损失主要是由于噪音损伤,耳毒性药物或年龄引起的HC损失。 虽然对HCs的损害在哺乳动物中被认为是永久性的,因为它们具有非常有限的HC再生能力,最近的研究表明SCs是有希望的内耳祖细胞,HC可以从中再生。 因此,SCs是基因治疗的重要潜在靶标,不仅用于纠正遗传听觉缺陷而且用于HC再生。
AAV在几种器官中显示出临床疗效和安全性,包括肝脏和视网膜。 然而,迄今为止,还没有基于AAV载体的耳蜗基因疗法。 一些研究已经在动物模型中测试了AAV介导的耳蜗基因疗法,结果很有希望。 然而,大多数集中在HC和螺旋神经节神经元(SGNs)。 虽然AAV1血清型用于将野生型GJB2递送到GJB2敲除小鼠的耳蜗SC中,但它不能恢复听觉功能,这可能是由于SCs22中AAV1的转导效率低。 实际上,已经在耳蜗中评估了一些AAV血清型,包括AAV1,并且所有测试的那些在SC中显示低转导率(0-13%)5。 因此,设计能够有效感染SC的新型AAV血清型是开发用于治疗遗传性听力损失和HC再生的基因疗法的关键。
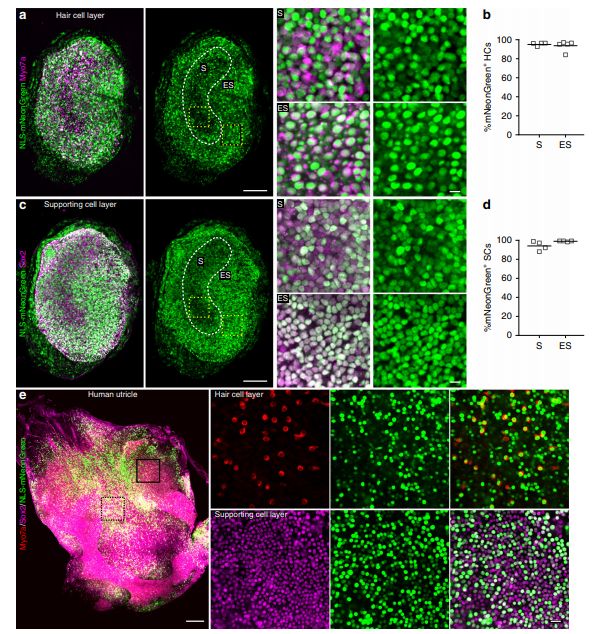
前庭感觉上皮细胞中的AAV-ie转导
听力丧失是最常见的感觉障碍。虽然基因治疗已成为听力丧失等遗传性疾病的有希望的治疗方法,但它依赖于基因传递载体的鉴定。腺相关病毒(AAV)载体介导的基因治疗已经在美国被批准用于治疗罕见的遗传性眼病,但尚未鉴定出能够靶向多种类型的内耳细胞的安全且有效的载体。 在这里,研究人员鉴定AAV变体,AAV-ie,用于小鼠内耳中的基因递送。 研究结果表明,AAV-ie能高效转导耳蜗支持细胞(SCs),代表了对传统AAV血清型的巨大改进。此外,在AAV-ie介导的Atoh1基因转移后,研究人员发现许多SC转分化为新的HC。 该研究结果表明,AAV-ie是一种有用的工具,可用于耳蜗基因治疗和研究HC再生的机制。








