治疗性单克隆抗体以其高特异性和安全性并且可以避免跨越细胞膜和内涵体逃逸等特点,已经成为临床上不可或缺的蛋白药物。但受限于其蛋白质结构的脆弱性,治疗性抗体经静脉注射后容易被降解和失活,这些问题降低了其半衰期和药效并容易引起免疫反应,限制了治疗性抗体的进一步应用。蛋白药物经纳米载体负载后可表现出优异的血液稳定性,较理想的循环时间以及一定的肿瘤靶向性,但目前绝大多数纳米载体由于其纳米级别的尺寸,很容易被细胞内吞,然而对于治疗性抗体这种以细胞膜上受体为靶点的药物,被细胞内吞后抗体将无法激活细胞的凋亡信号,药效的发挥受到限制。因此,构建一种可以保护治疗性抗体,促进其在细胞外精准释放并增进其功能的载体体系对治疗性抗体的临床应用具有重要意义。
近日,天津大学材料学院原续波教授、赵瑾副教授团队与天津医科大学总医院康春生教授团队合作,在Advanced Functional Materials 上发表文章Tumor Microenvironment-Tailored Weakly Cell-Interacted Extracellular Delivery Platform Enables Precise Antibody Release and Function,报导了一种肿瘤微环境响应性弱细胞相互作用纳米载体(WINNER)用于保护治疗性抗体,当载体表面的磷酰胆碱(PC)填充率处于适宜范围时,该体系能够实现治疗性抗体的细胞外精准释放,从而增进其对肿瘤的治疗效果。

研究者受纳米粒子和细胞之间相互作用的启发,设想当治疗性抗体表面覆盖具有适宜两性离子表面填充率的两性离子外壳时,由于外壳与细胞之间弱的相互作用,外壳会保护治疗性抗体使其不被细胞内吞,并且,若该外壳是由酶敏感多肽组装的,适宜的外壳表面PC填充率会使外壳留有足够的酶接触位点,可确保载体在微环境中发生酶降解,从而最终实现治疗性抗体的细胞外精准释放(图1)。
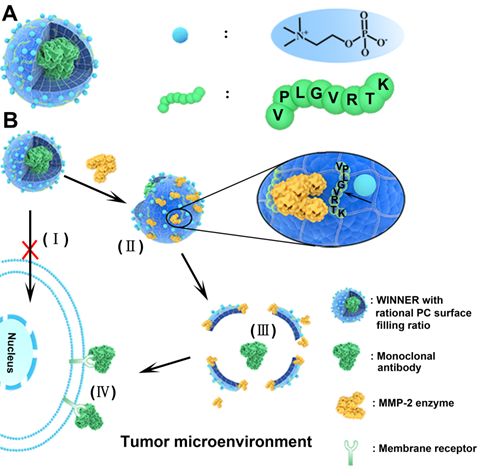
图1细胞外精准释放治疗性抗体的WINNER系统的构建思路
研究结果显示当WINNER的表面磷酰胆碱填充率在50.5%-58.3%时,WINNER可以高效地保护内核蛋白不被细胞内吞并同时在酶过表达的环境下进行酶响应性降解,从而实现精准细胞外投递治疗性抗体的目的。经静脉注射以后,负载尼妥株单抗的WINNER(PC表面填充率为~51.2%)的肿瘤抑制效果远高于纯尼妥株单抗和负载尼妥株单抗的无PC载体(n-WINNER)。
WINNER体系的特色之处在于:
1. 弱细胞相互作用纳米粒子首次应用于细胞外释放载体。精准细胞外投递治疗性抗体要求负载治疗性抗体的纳米载体在到达靶点部位后不能或极少被细胞内吞,而传统纳米粒子往往由于其纳米级别的粒径容易被细胞摄取。细胞与纳米粒子之间的相互作用强弱是决定纳米粒子是否会被细胞内吞的关键。研究者首次利用弱相互作用力纳米粒子作为细胞外投递载体,由两性粒子PC组装而成的WINNER与细胞之间相互作用力弱,共聚焦显微镜、流式细胞术及离子电导显微镜结果证明WINNER可以有效避免细胞内吞。
2.通过调节PC表面填充率实现抑制细胞内吞和酶响应降解的矛盾。纳米粒子在靶点部位降解是释放其内部治疗性抗体的关键。然而,用于保护治疗性抗体不被细胞内吞的外壳成分PC亲水性极强,可能导致酶吸附的抑制,因此过高的PC含量将导致纳米粒子酶解困难。研究者通过调节WINNER表面PC填充率,解决了避免内吞和酶响应降解之间的矛盾。结果显示,当PC表面填充率在50.5%-58.3%时,WINNER可以避免被细胞内吞,并且实现酶响应降解,从而精准细胞外投递治疗性抗体。
3.WINNER是一个简单且普适性的精准细胞外投递载体。WINNER的合成基于简单温和的原位自由基聚合方法,对蛋白类药物的负载具有普适性。考虑到蛋白类药物具有极其重要的临床应用价值,WINNER体系的应用前景广阔。
综上所述,考虑到目前临床获批的治疗性抗体药物逐年增多,已成为国际制药业和临床医生关注的焦点。WINNER这一精确细胞外投递体系将有助于这些靶点在细胞外的蛋白类药物高效发挥其治疗效果,具有重大的理论和现实意义。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.201903296








